|
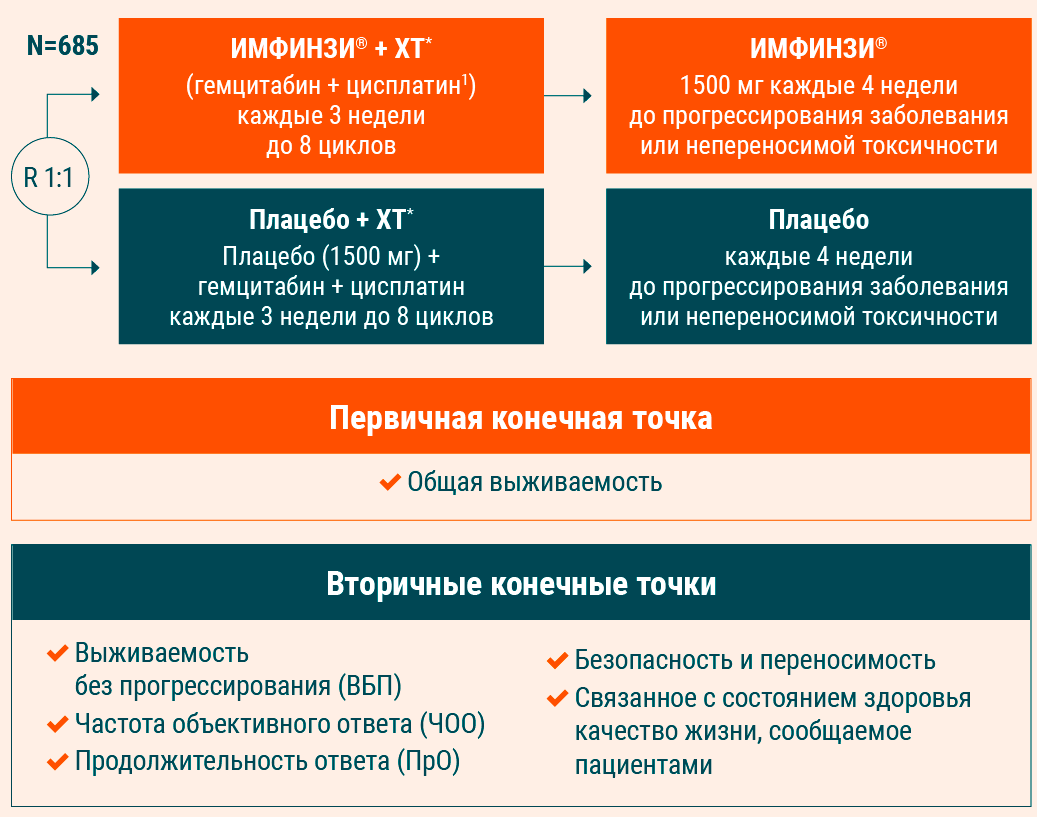
* Химиотерапия – гемцитабин + цисплатин
|
|
|
Список литературы: 1. Инструкция по медицинскому применению препарата ИМФИНЗИ®, концентрат для приготовления раствора для инфузий,
50 мг (ЛП-005664 с изм. №2 от 06.12.2022); 2. Oh DY, He AR, Qin S, et al. Updated overall survival from the Phase 3 TOPAZ-1 study of durvalumab
or placebo plus gemcitabine and cisplatin in patients with advanced biliary tract cancer. Poster presented at: 2022 ESMO Congress; September 9–13,
2022; Paris, France; 3. Rizzo A, Brandi G. First-line chemotherapy in advanced biliary tract cancer ten years after the ABC-02 trial: “And yet
it moves!” Cancer Treat Res Commun. 2021;27:100335; 4. Valle J, Wasan H, Palmer DH, et al. Cisplatin plus gemcitabine versus gemcitabine for biliary
tract cancer. N Engl J Med. 2010;362(14):1273–1281; 5. Gomez-Espana et al. Clin Transl Oncol. https://doi.org/10.1007/s12094-021-02573-1.
доступен на 24 марта 2021; 6. Marcano-Bonilla et al. Chin Clin Oncol. 2016; 5:61. https://doi.org/10.21037/cco.2016.10.09.
доступен на 24 марта 2021; 7. Данные регистра пациентов «Рак желчевыводящего тракта». «Бредер В. В. Конференция МОСОП «Рак печени – болезнь, которая
существует», г. Москва, 14 октября 2022 г.; 8. Valle et al. N Engl J Med. 2010;362:1273–1281; 9. Vogel, A. et al. Biliary tract cancer: ESMO Clinical
Practice Guideline for diagnosis, treatment and follow-up. Ann. Oncol. 101890 (2022) doi:10.1016/j.annonc.2022.10.506. 10. Бредер и сотр. Практические
рекомендации по лекарственному лечению больных злокачественными опухолями печени и желчевыводящей системы. Злокачественные опухоли 12, 467–529
(2022); 11. NCCN Hepatobiliary cancers 2022 v.3 https://www.nccn.org/ professionals/physician_gls/ pdf/hepatobiliary.pdf
доступно на 14.11.2022; 12. Oh DY, He AR, Qin S, et al. Durvalumab plus gemcitabine and cisplatin in advanced biliary tract cancer. NEJM Evidence.
2022. doi:10.1056/EVIDoa2200015 (including Supplementary Appendix and Protocol).
|
|
|
Сокращения: ВБП – выживаемость без прогрессирования; ВОЗ – Всемирная организация здравоохранения; вХК – внутрипеченочная холангиокарционома; внеХК
– внепеченочная холангиокарцинома; ДИ – доверительный интервал; МКР – межквартальный размах; НЯ – нежелательные явления;ОВ – общая выживаемость;
ОР – отношение рисков; ПрО – продолжительность ответа; РЖС – рак желчевыводящей системы; РЖП – рак желчного пузыря; РФ – Российская Федерация;
ХТ – химиотерапия; ЧОО – частота объективного ответа; PD-L1 – лиганд рецептора программируемой клеточной гибели-1.
|
|
|
Имеются противопоказания. Перед применением ознакомьтесь, пожалуйста,
с полной инструкцией по медицинскому применению лекарственного препарата.
Если Вам стало известно о нежелательной реакции при использовании лекарственного препарата «АстраЗенека», пожалуйста, сообщите эту информацию
в медицинский отдел компании. Вы можете написать нам по электронной почте
Safety.Russia@astrazeneca.com,
заполнить
веб-форму
или связаться с нами по телефону 8 (495) 799–56–99, доб. 2580.
|
|
Краткая инструкция по медицинскому применению препарата ИМФИНЗИ®
Торговое наименование: ИМФИНЗИ®. Регистрационный номер: ЛП-005664 с изм. №2 от 06.12.2022.
Международное непатентованное название: дурвалумаб.
Фармакотерапевтическая группа: противоопухолевое средство, антитела моноклональные. Лекарственная форма: концентрат для приготовления
раствора для инфузий. Состав: в 1 мл концентрата содержится: действующее вещество: дурвалумаб 50 мг; вспомогательные вещества: L-гистидин 2 мг,
L-гистидина гидрохлорида моногидрат 2,7 мг, α, α-трегалозы дигидрат 104 мг, полисорбат 80 0,2 мг, вода для инъекций приблизительно 900 мг.
Показания к применению: нерезектабельный местнораспространенный немелкоклеточный рак легкого у взрослых пациентов, у которых не выявлено прогрессирование
заболевания после химиолучевой терапии на основе препаратов платины. Первая линия терапии распространенного мелкоклеточного рака легкого в комбинации
с этопозидом и карбоплатином или цисплатином. Местнораспространенный или метастатический рак желчевыводящей системы в комбинации с химиотерапией.
Противопоказания: повышенная чувствительность к дурвалумабу или вспомогательным веществам, входящим в состав препарата, детский возраст до 18 лет,
беременность и период грудного вскармливания, нарушение функции печени тяжелой степени.
С осторожностью: тяжелые аутоиммунные заболевания в активной
стадии, при которых дальнейшая активация иммунной системы может представлять потенциальную угрозу жизни. Способ применения и дозы. Препарат ИМФИНЗИ®
необходимо вводить в виде внутривенной инфузии продолжительностью не менее 1 часа. Местнораспространенный НМРЛ: рекомендуемая доза препарата ИМФИНЗИ®
составляет 10 мг/кг один раз в 2 недели или 1500 мг один раз в 4 недели до прогрессирования заболевания или развития неприемлемой токсичности
(пациентам с массой тела не более 30 кг препарат ИМФИНЗИ® назначают из расчета 10 мг/кг один раз в 2 недели или 20 мг/кг один раз в 4
недели в качестве монотерапии до достижения массы тела более 30 кг). Распространенный МРЛ: рекомендуемая доза препарата ИМФИНЗИ® составляет
1500 мг в комбинации с химиотерапевтическими препаратами один раз в 3 недели в течение 4 циклов, затем 1500 мг в качестве монотерапии один раз
в 4 недели до прогрессирования заболевания или развития неприемлемой токсичности (пациентам с массой тела не более 30 кг препарат ИМФИНЗИ®
назначают из расчета 20 мг/кг в комбинации с химиотерапевтическими препаратами один раз в 3 недели в течение 4 циклов, затем 20 мг/кг в качестве
монотерапии один раз в 4 недели до достижения массы тела более 30 кг; препарат ИМФИНЗИ® следует вводить до введения химиотерапевтических
препаратов при их назначении в один и тот же день). Увеличение или уменьшение дозы препарата не рекомендуется. С учетом переносимости и безопасности
препарата может потребоваться приостановка терапии или ее отмена. Местнораспространенный или метастатический РЖС: рекомендуемая доза препарата
ИМФИНЗИ® составляет 1500 мг в комбинации с химиотерапевтическими препаратами один раз в 3 недели, затем 1500 мг в качестве монотерапии
один раз в 4 недели до прогрессирования заболевания или развития неприемлемой токсичности.
Приготовление раствора: препарат ИМФИНЗИ®
не содержит консервантов, каждый флакон предназначен для однократного применения. Следует соблюдать правила асептики при приготовлении раствора.
Перед применением проводят визуальный осмотр лекарственного препарата на предмет наличия механических включений и изменения цвета. Если раствор
мутный, его цвет изменен, и отмечаются видимые частицы, флакон утилизируют. Не следует встряхивать флакон. Из флакона (флаконов) извлекают нужный
объем препарата ИМФИНЗИ® и переносят во флакон для внутривенной инфузии, содержащий 0,9% раствор натрия хлорида для инъекций или 5%
раствор глюкозы для инъекций. Перемешивают разведенный раствор посредством осторожного переворачивания. Раствор не встряхивать и не замораживать.
Окончательная концентрация разведенного раствора должна составлять 1–15 мг/мл. Из флакона следует извлекать только одну дозу препарата; не следует
повторно прокалывать флакон для извлечения еще одной дозы препарата. Частично использованные флаконы препарата ИМФИНЗИ® утилизируют.
Хранение раствора для инфузий: препарат ИМФИНЗИ® не содержит консервантов. Раствор для инфузий вводят сразу же после приготовления.
Если раствор для инфузий вводят не сразу, и его необходимо хранить, то суммарное время с момента прокола флакона до начала введения не должно
превышать: 24 часа при хранении в холодильнике при температуре от 2 до 8°C; 4 часа при хранении при комнатной температуре до 25°C. Введение:
раствор для инфузий вводят внутривенно, продолжительность введения не менее 60 минут через внутривенный катетер со стерильным встроенным 0,2 или
0,22 микронным фильтром с низким связыванием белков. Через одну и ту же инфузионную систему нельзя одновременно вводить другие лекарственные препараты.
Неиспользованный лекарственный препарат и расходные материалы следует утилизировать в соответствии с локальными требованиями. Побочное действие:
профиль безопасности препарата ИМФИНЗИ® в монотерапии был изучен на основании объединенных данных 3006 пациентов с различными типами
опухолей, принимавших участие в 9 исследованиях. Наиболее частыми нежелательными реакциями были кашель (21,5%), диарея (16,3%) и сыпь (16,0%).
Нежелательные реакции у пациентов, получавших препарат ИМФИНЗИ® в монотерапии. Определение частоты возникновения нежелательных реакций:
очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000), очень редко (<1/10000),
неуточненной частоты (частота не может быть определена на основании имеющихся данных). Нарушения со стороны дыхательной системы, органов грудной
клетки и средостения: очень часто – кашель (частота нежелательных реакций 3–4 степени – 0,4%), часто – пневмонит (частота нежелательных реакций
3–4 степени – 0,9%), дисфония (частота нежелательных реакций 3–4 степени – <0,1%), нечасто – интерстициальная болезнь легких (частота нежелательных
реакций 3–4 степени – 0,1%). Нарушения со стороны печени и желчевыводящих путей: часто – увеличение активности АСТ или АЛТ (частота нежелательных
реакций 3–4 степени – 2,3%), нечасто – гепатит (частота нежелательных реакций 3–4 степени – 0,4%). Нарушения со стороны желудочно-кишечного
тракта: очень часто – боль в животе (частота нежелательных реакций 3–4 степени – 1,8%), диарея (частота нежелательных реакций 3–4 степени – 0,6%),
нечасто – колит (частота нежелательных реакций 3–4 степени – 0,3%). Нарушения со стороны эндокринной системы: очень часто – гипотиреоз (частота
нежелательных реакций 3–4 степени – 0,2%), часто – гипертиреоз (частота нежелательных реакций 3–4 степени – 0), нечасто – тиреоидит (частота
нежелательных реакций 3–4 степени – <0,1%), недостаточность надпочечников (частота нежелательных реакций 3–4 степени – <0,1%), редко
– гипофизит/гипопитуитаризм, (частота нежелательных реакций 3–4 степени – <0,1%), сахарный диабет 1 типа (частота нежелательных реакций
3–4 степени – <0,1%), несахарный диабет (частота нежелательных реакций 3–4 степени – <0,1%). Нарушения со стороны почек и мочевыводящих
путей: часто – увеличение концентрации креатинина в сыворотке крови (частота нежелательных реакций 3–4 степени – <0,1%), дизурия (частота
нежелательных реакций 3–4 степени – 0), нечасто – нефрит (частота нежелательных реакций 3–4 степени – <0,1%). Нарушения со стороны кожи
и подкожных тканей: очень часто – сыпь (частота нежелательных реакций 3–4 степени – 0,6%), зуд (частота нежелательных реакций 3–4 степени – <0,1%),
часто – потливость в ночное время (частота нежелательных реакций 3–4 степени – <0,1%), нечасто – дерматит (частота нежелательных
реакций 3–4 степени – <0,1%), редко – пемфигоид (частота нежелательных реакций 3–4 степени – 0). Нарушения со стороны сердца: редко – миокардит
(частота нежелательных реакций 3–4 степени – <0,1%). Общие расстройства и реакции в месте введения: очень часто – лихорадка (частота нежелательных
реакций 3–4 степени – 0,3%), часто – периферические отеки (частота нежелательных реакций 3–4 степени – 0,3%). Инфекционные и паразитарные заболевания:
очень часто – инфекции верхних дыхательных путей (частота нежелательных реакций 3–4 степени – 0,2%), часто – пневмония (частота нежелательных
реакций 3–4 степени – 3,5%), кандидоз полости рта (частота нежелательных реакций 3–4 степени – 0), дентальные инфекции и инфекции мягких тканей
полости рта (частота нежелательных реакций 3–4 степени – <0,1%), грипп (частота нежелательных реакций 3–4 степени – <0,1%). Нарушения
со стороны скелетно-мышечной и соединительной ткани: часто – миалгия (частота нежелательных реакций 3–4 степени – <0,1%), нечасто – миозит
(частота нежелательных реакций 3–4 степени – <0,1%), неуточненной частоты – полимиозит (частота нежелательных реакций 3–4 степени – неуточненной
частоты). Нарушения со стороны нервной системы: неуточненной частоты – миастения гравис (частота нежелательных реакций 3–4 степени – неуточненной
частоты). Нарушения со стороны крови и лимфатической системы: редко – иммунная тромбоцитопения (частота нежелательных реакций 3–4 степени – 0,03%).
Травмы, интоксикации и осложнения процедур: часто – реакции, связанные с введением препарата (частота нежелательных реакций 3–4 степени – 0,2%).
Профиль безопасности препарата ИМФИНЗИ® в комбинации с химиотерапевтическим препаратами был оценен у 265 пациентов в исследовании CASPIAN;
он соответствует профилю безопасности препарата ИМФИНЗИ® при монотерапии и известному профилю безопасности химиотерапевтических препаратов.
Особые указания. Иммуноопосредованный пневмонит, или интерстициальная болезнь легких, требующий применения системных глюкокортикостероидов и не имеющий
альтернативной причины, отмечался у пациентов, получающих препарат ИМФИНЗИ®. Необходимо контролировать появление признаков и симптомов
пневмонита. При подозрении на пневмонит следует провести рентгенологическое исследование для подтверждения диагноза, а также исключить другие
причины, инфекционные и связанные с основным заболеванием. Иммуноопосредованный гепатит, требующий применения системных глюкокортикостероидов
и не имеющий альтернативной причины, отмечался у пациентов, получающих препарат ИМФИНЗИ®. Следует контролировать показатели функции
печени у пациентов до начала терапии и периодически – во время терапии. Иммуноопосредованный колит или диарея, требующие применения системных
глюкокортикостероидов и не имеющие альтернативной причины, отмечались у пациентов, получающих препарат ИМФИНЗИ®. Необходимо контролировать
появление признаков и симптомов колита или диареи. Иммуноопосредованный гипотиреоз, гипертиреоз и тиреоидит отмечались у пациентов, получающих
препарат ИМФИНЗИ®. Следует контролировать показатели функции щитовидной железы у пациентов до начала терапии и периодически – во время
терапии. Иммуноопосредованная недостаточность функции надпочечников отмечалась у пациентов, получающих препарат ИМФИНЗИ®. Необходимо
контролировать появление клинических признаков и симптомов недостаточности функции надпочечников. Иммуноопосредованный сахарный диабет 1 типа
отмечался у пациентов, получающих препарат ИМФИНЗИ® (см. раздел «Побочное действие»). Необходимо контролировать появление клинических
признаков и симптомов cахарного диабета 1 типа. Иммуноопосредованный гипофизит/гипопитуитаризм отмечался у пациентов, получающих препарат ИМФИНЗИ®.
Необходимо контролировать появление клинических признаков и симптомов гипофизита или гипопитуитаризма. Иммуноопосредованный нефрит, требующий
применения системных глюкокортикостероидов и не имеющий альтернативной причины, отмечался у пациентов, получающих препарат ИМФИНЗИ®.
Следует контролировать показатели функции почек у пациентов до начала терапии и периодически – во время терапии. Иммуноопосредованная сыпь или
дерматит (включая пемфигоид), требующие применения системных глюкокортикостероидов и не имеющие альтернативной причины, отмечалась у пациентов,
получающих препарат ИМФИНЗИ®. Необходимо контролировать появление клинических признаков и симптомов сыпи и дерматита. С учетом механизма
действия препарата ИМФИНЗИ®, могут возникать другие иммуноопосредованные нежелательные реакции. Необходимо контролировать появление
клинических признаков и симптомов. Другими иммуноопосредованными нежелательными реакциями являются миастения гравис, миокардит, миозит, полимиозит
и иммунная тромбоцитопения. Необходимо контролировать появление клинических признаков и симптомов реакций, связанных с введением препарата. Материал
предназначен для специалистов здравоохранения (работников здравоохранения, фармацевтических работников). Перед назначением препарата необходимо
ознакомиться с полным текстом инструкции по медицинскому применению. Дальнейшая информация предоставляется по требованию: ООО «АстраЗенека Фармасьютикалз»,
Россия, 123100, Москва, 1-й Красногвардейский пр-д, д. 21, стр. 1, этаж 30. Телефон: +7 (495) 799-56-99, факс: +7 (495) 799-56-98.
|
|